Medición de la vitalidad de los árboles urbanos.

Revisión de las escuelas de pensamiento relacionadas con la medición de la vitalidad de los árboles a través del crecimiento de los árboles, mediciones fisiológicas y pruebas de fluorescencia de clorofila.
Comprender la salud de nuestros árboles urbanos es una parte importante de cualquier rol de arboricultor, pero ¿cómo es exactamente que podemos medir esto? Hay diferentes escuelas de pensamiento relacionadas con la medición de la vitalidad de los árboles que giran en torno al crecimiento de los árboles, las mediciones fisiológicas y la prueba de la fluorescencia de la clorofila de las hojas. Sin embargo, medida, la información subsiguiente de medir la vitalidad de un árbol puede ser esencial en algunas situaciones de manejo de árboles. Ser capaz de conocer la vitalidad de un árbol aparentemente en declive puede marcar la diferencia en la decisión de talarlo o retenerlo, si muestra buena vitalidad, entonces hay un argumento para retenerlo como puede ser el árbol a través de cualquier estrés o tensión que haya causado la inicial. declinar y ahora puede estar en proceso de recuperación,
Crecimiento del árbol
El crecimiento de los árboles como método para medir la vitalidad del árbol se basa en el principio de que un árbol crecerá menos si está estresado o no es saludable (poca vitalidad) y, como tal, será más pequeño de lo que sería si el árbol estuviera sano y sin tensiones significativas. . Hay varias medidas diferentes del crecimiento de los árboles que se pueden utilizar para medir la vitalidad de los árboles.
La medición de la altura y el diámetro del árbol a la altura del pecho se ha utilizado durante muchos años con respecto a la vitalidad del árbol. Estas mediciones se han utilizado en muchos experimentos sobre los efectos de diversas tensiones arbóreas comunes, como la profundidad de plantación y los efectos de la sequía. Estas mediciones son sencillas y rápidas de realizar y puede realizarlas cualquier persona con un conocimiento básico de cómo medir alturas y diámetros. La metodología se basa en el principio de que un árbol estresado o con poca vitalidad tendrá un tallo de diámetro más delgado y será más corto en altura, aunque no puedo discutir la lógica o la precisión de esto, existen algunos problemas con el uso de este método en Árboles urbanos maduros.

La medición de la altura y el diámetro de los árboles a la altura del pecho tiene importantes beneficios en la evaluación de árboles jóvenes recién plantados en experimentos y en el entorno urbano; sin embargo, cuando se utiliza en árboles más viejos y grandes, existen algunas dudas sobre su eficacia. A lo largo de la vida de un árbol, es probable que experimente una amplia gama de tensiones y tensiones externas que pueden variar desde tensiones ambientales naturales hasta las causadas por las actividades de los seres humanos. La intensidad y frecuencia de estos factores externos pueden variar de un árbol a otro dentro de la misma calle y aún más en la extensión de una ciudad, condado o país. Como tal, es probable que la altura y el diámetro del árbol a la altura del pecho sea tan variable en los árboles más viejos que no se puede usar definitivamente como una medida precisa de la vitalidad de un árbol y esto no incluye la variación genética natural entre los especímenes que pueden tener una significativa efecto sobre la tasa de crecimiento potencial de cualquier árbol. Por supuesto, los extremos estarán presentes y serán confiables, como una avenida de tilos todos plantados al mismo tiempo, si uno de ellos es significativamente más corto y tiene un diámetro de tronco menor a la altura del pecho es probable que su vitalidad sea menor que la que lo rodea. vecinos más grandes, sin embargo, esto podría ser genético.
Es importante recordar que los árboles tienen recursos almacenados y sus tasas de crecimiento dependen en parte de los carbohidratos almacenados en años anteriores. Como tal, todas las mediciones de crecimiento de árboles sufrirán un retraso de tiempo, lo que significa que existe la posibilidad de que las reducciones en las tasas de crecimiento se puedan medir demasiado tarde después de que ocurrió el factor externo y posteriormente causó un daño significativo al árbol o que el evento ha ocurrido y ha sido «Tratado» por el árbol, lo que hace que la medición esté «desactualizada» y sea bastante irrelevante como una medición única.
Es importante recordar que el crecimiento de los árboles varía de un año a otro debido a una cantidad inconmensurable de factores externos, a menos que las mediciones sean bastante extremas de una forma u otra, creo que la utilidad de las mediciones de un año tiene el potencial de ser bastante irrelevante dentro de la vida útil de muchas especies de árboles.
Sin embargo, ¿qué pasa con las hojas? En los árboles de hoja caduca, estos se reemplazan cada año.

Existen métodos para medir el área foliar de los árboles y usar esto como una medida de la vitalidad del árbol. El índice de área foliar es la relación entre el área foliar y el área del suelo y es un método ampliamente utilizado para analizar el crecimiento de cultivos o áreas forestales. No es realmente práctico ni efectivo cuando se usa para árboles urbanos individuales. Para especímenes individuales, podemos medir las áreas foliares directas y combinar esto con el peso de las hojas para crear una ración llamada área foliar específica (SLA). SLA se define como la relación entre el área foliar proyectada y la masa seca de la hoja. El SLA reacciona con sensibilidad a muchos factores que afectan a los árboles, como la disponibilidad de recursos (luz, nutrición) y limitaciones hidráulicas y menores potenciales hídricos en ramas de mayor altura. Debido a esto, es esencial que las hojas se recolecten en posiciones similares dentro de los árboles (aspecto, altura, distancia a lo largo de la rama) para garantizar una comparación precisa con los árboles circundantes y otros árboles medidos. El SLA es efectivamente una medida de la densidad y, posteriormente, la salud de las hojas individuales. Debido a que las hojas se reemplazan regularmente (aunque a diferentes velocidades para diferentes especies), esto permite una medición más «actualizada» de la vitalidad del árbol. Un SLA más bajo tenderá a indicar una menor vitalidad del árbol, en estudios de Pierce et al. 1994; Cornelissen y col. 2003; White y Scott 2006; Poorter y col. 2009, se encontró que los árboles que están bien provistos de nutrientes tendían a tener un SLA más alto que la misma especie de árbol ubicada en ambientes pobres en nutrientes. Debido a que las hojas se reemplazan regularmente (aunque a diferentes velocidades para diferentes especies), esto permite una medición más «actualizada» de la vitalidad del árbol. Un SLA más bajo tenderá a indicar una menor vitalidad del árbol, en estudios de Pierce et al. 1994; Cornelissen y col. 2003; White y Scott 2006; Poorter y col. 2009, se encontró que los árboles que están bien provistos de nutrientes tendían a tener un SLA más alto que la misma especie de árbol ubicada en ambientes pobres en nutrientes. Debido a que las hojas se reemplazan regularmente (aunque a diferentes velocidades para diferentes especies), esto permite una medición más «actualizada» de la vitalidad del árbol. Un SLA más bajo tenderá a indicar una menor vitalidad del árbol, en estudios de Pierce et al. 1994; Cornelissen y col. 2003; White y Scott 2006; Poorter y col. 2009, se encontró que los árboles que están bien provistos de nutrientes tendían a tener un SLA más alto que la misma especie de árbol ubicada en ambientes pobres en nutrientes.
El SLA de una hoja es muy sensible a una amplia gama de factores, muchos de los cuales pueden variar a lo largo de la temporada de crecimiento, la luz, la disponibilidad de nutrientes y, como tal, los resultados deben compararse con muchos otros árboles de la misma especie y en cultivos similares. posiciones para permitir un resultado preciso. La impracticabilidad de este método es una desventaja significativa, la eliminación de hojas de diferentes partes del árbol, mientras que también se encuentran en las mismas posiciones en otros árboles probados, requerirá acceso aéreo (escalada, MEWP) que requiere tiempo y dinero. A menos que el árbol sea particularmente valioso o se esté realizando un estudio, no parece razonable esperar que el propietario de un árbol esté financiando dicha investigación cuando hay muchos otros métodos disponibles.
La arquitectura de las copas de los árboles se puede utilizar como medida de la vitalidad de los árboles. Es comúnmente utilizado por los inspectores de árboles, para ser honesto, es comúnmente usado por todos los que miran un árbol y dicen que piensan que se ve «insalubre» o «ese árbol no se ve bien, creo que deberíamos pedirle a alguien que lo mire» it ”, aunque muchas personas están utilizando la base de este método sin saberlo. En 2017, en la conferencia anual de la asociación arborícola, el Dr. Andreas Roloff presentó una metodología para utilizar los síntomas por encima del suelo como una medida de la vitalidad del árbol, dentro de la cual propuso que la transparencia de la copa y los patrones de ramificación de los árboles son los métodos más prácticos para evaluar la vitalidad de los árboles.

La transparencia de la copa es un método fácil de aprender, rápido de realizar y, sobre todo, practicable para evaluar la vitalidad de los árboles, se basa en las diferencias en la cantidad de luz que penetra en la copa de un árbol y se clasifica en una escala de 0-3.
Aunque tiene importantes beneficios, existen importantes desventajas con este método.
· Existen variaciones naturales en la transparencia de la corona. Por ejemplo, Betula pendula permite grandes cantidades de luz a través de su dosel, mientras que en el otro extremo de la escala Cupressus × leylandii permite muy poca.
· En especies de hoja caduca esta metodología solo es realmente confiable durante 4 meses al año
· La fructificación y el clima pueden influir en los resultados
· El daño al árbol, como la pérdida de ramas, dará como resultado una mayor penetración de luz y puede dar lugar a una mala interpretación.
· En algunos árboles no es posible tener un 10% de transparencia en la copa debido a sus características de crecimiento, lo que significa que, en el mejor de los casos, están clasificados como 1 o 2 en la escala a pesar de no tener problemas de vitalidad.
· La edad del árbol puede afectar los resultados
Debido a los problemas anteriores, Roloff propuso que el uso de la arquitectura de rama es una medida más precisa de la vitalidad del árbol. Propuso que utilizando la arquitectura de ramas y copas podemos evaluar la vitalidad de los árboles en cualquier época del año. A continuación se muestra una imagen que muestra las etapas de vitalidad 0-3 en relación con la arquitectura de las ramas y el dosel.

0 En la etapa 0 podemos ver que el dosel es denso, hay una buena extensión de la copa y la arquitectura de las ramas es muy parecida a una lanza.
1 En la etapa 1, el contorno es puntiagudo, la corona exterior ha comenzado a adelgazarse y el dosel tiene algunas formas tipo cepillo de botella en su periferia. Hay poca o ninguna arquitectura de lanza.
2 En la etapa 2, el dosel se vuelve más escaso, solo contiene brotes cortos y parece más tupido en la naturaleza que como un dosel singular.
3 La etapa 3 muestra la reducción del dosel. El líder ha muerto y la corona se está reduciendo en tamaño y densidad.
(la imagen es originalmente de la presentación de A.Roloff en la conferencia de AA de 2017)
Esta metodología es fácil de entender y poner en práctica, de hecho muchas personas utilizan sus principios todos los días sin necesariamente saberlo. Lo más importante es que es eficaz durante los 12 meses del año.
La principal desventaja o al menos la posibilidad de mal uso / diagnóstico erróneo es que se debe conocer la edad aproximada del árbol y si la condición de ese árbol es normal para esa edad. Por ejemplo, Quercus robur es un árbol de larga vida, pero es conocido por su reducción natural hasta que se vuelve bajo y achaparrado. Si un Quercus robur maduro está en la etapa 2 y se considera que tiene aproximadamente 500 años de edad, podríamos considerar que es bastante normal y que, a menos que haya una indicación obvia de lo contrario, es probable que esté entrando en su etapa de reducción natural. Sin embargo, si el mismo árbol solo tuviera alrededor de 150 años, estar en la etapa 2 indicaría que algo anda mal y provocaría que el árbol entre en una reducción temprana o una espiral de mortalidad.
Si bien este es un método extremadamente útil y eficaz para medir la vitalidad de los árboles, creo que solo formaliza lo que muchas personas hacen cuando ya evalúan árboles.
Medidas fisiológicas
Admisión / impedancia eléctrica
Shigo y Shortle desarrollaron el principio de utilizar la admitancia / impedancia eléctrica para medir la vitalidad de los árboles. El principio establece que los árboles con mayor vitalidad tienen mayor contenido de humedad, por lo tanto, mayor concentración de catión móvil en sus tejidos vasculares y menor concentración de iones móviles. Shigo desarrolló su «Shigometer» como una herramienta para medir la admitancia / impedancia eléctrica. Utiliza dos sondas de aguja que se empujan a través de la corteza, el cambium y ligeramente dentro de la madera. La corriente eléctrica pulsada del medidor pasa a través de una aguja, a través de los tejidos del árbol y de regreso a través de la otra aguja al ohmímetro en el “Shigometer” donde se mide la resistencia en kiloohmios. Debido a que la zona cambial es muy húmeda y contiene una gran cantidad de cationes, la mayor parte de la corriente fluye a través de esta zona. Cuanto mayor sea la resistencia eléctrica, menos vital será el árbol. Es importante tener una línea de base con la que comparar las lecturas, para hacer esto, se deben medir al menos 20 árboles sanos de la misma especie antes de la prueba.
Harris, Clark y Matheny, desarrollaron el medidor de relación de impedancia de la planta en 2004, usó dos sondas de aguja como el «Shigometer» pero en su lugar midió la impedancia de una corriente alterna sobre 2 frecuencias para medir la resistencia eléctrica cambial (CER).
Se han realizado muchos estudios sobre la eficacia de la medición de la resistencia eléctrica cambial (CER) y su uso tiene una medida de la vitalidad del árbol que ha producido resultados mixtos. Efectivamente, hay algunos problemas con la metodología. La confiabilidad de los resultados varía entre las diferentes especies de árboles, la causa del estrés de los árboles y la época del año, ciertamente hay una diferencia en la cantidad de humedad dentro del árbol en diferentes épocas del año. La investigación citada en «La medición de la vitalidad de las plantas en los árboles del paisaje» por Denise Johnstone, Gregory Moore, Michael Tausz y Marc Nicolas, declaró que Clark, Kjelgran, Hushagen y Fiore (1992) encontraron que el CER no podía detectar cambios vitalidad en comparación con el crecimiento del diámetro en Liquidamber styracifluapero a la inversa Martinez-Trinidad et al. (2010) pudieron detectar la vitalidad del árbol en Quercus virginiana maduro en comparación con una evaluación visual de los árboles cuando sus síntomas eran agudos. Varios otros estudios produjeron variaciones similares en la eficacia de CER.
En 2006, Gibert, Le Mouel, Lambs, Nicollin y Perrier encontraron evidencia de una relación directa entre el flujo de savia y el potencial eléctrico en el tronco de un Populus nigra en la primavera, pero no en el verano. Esto indica que es probable que la época del año tenga un efecto significativo en los resultados de cualquier prueba de resistencia eléctrica o de admitancia.
Intercambio gaseoso
La ingesta de dióxido de carbono y la liberación de agua tienen lugar a través de los estomas de los árboles. La medición del intercambio gaseoso puede proporcionar una indicación de la vitalidad del árbol. Estas medidas permiten estimar la asimilación de CO2, la conductancia estomática y la transpiración. La investigación de Epron, Dreyer y Breda en 1992 encontró que un Quercus petraea que sufría de estrés por sequía mostraba una disminución en la asimilación de CO2 de las hojas, se encontraron resultados similares en Quercus ilexpor Peria-Rojas et al en 2005. Si se está produciendo muy poco intercambio gaseoso, es probable que haya poca vitalidad, mientras que grandes cantidades de intercambio gaseoso indicarían una buena vitalidad y un árbol sano. Realmente es necesario que haya una línea de base para comparar las lecturas en muchos casos y se necesitarían pruebas en múltiples árboles de la misma especie en la misma área para formar una conclusión confiable sobre un árbol urbano singular en ausencia de algunos resultados extremos, p. sin intercambio gaseoso. Las mediciones tomadas para medir el intercambio gaseoso se llevan a cabo mediante un analizador de gases infrarrojos (IRGA), esta es una herramienta compleja de usar y también es costosa de comprar, por lo que se usa principalmente solo con fines de investigación. El intercambio gaseoso solo se puede realizar mientras el árbol está en la hoja y presumiblemente mientras el árbol no está sujeto a algunos factores externos como la sequía. Mientras esté seco, un árbol cerrará sus estomas, por lo que es probable que haya una reducción o cese notable en el intercambio gaseoso y la liberación de agua a través de la transpiración, ya que tales pruebas en este momento no proporcionarían una medición precisa de la vitalidad del árbol y sería predecible que el árbol no estaría en pleno estado de salud, aunque después del evento de sequía, el uso de este método podría indicar qué árboles, por ejemplo, a lo largo de una calle sufrieron peor debido al evento de sequía y, posteriormente, pueden necesitar un manejo diferente.
Prueba de fluorescencia de clorofila
Normalmente, un árbol sano utilizará alrededor del 78-85% de la luz solar que recibe en la superficie de la hoja para procesos de vida como la fotosíntesis. La luz solar restante se dispersa o refleja. Una hoja de árbol hará esto a través de procesos no fotoquímicos: reemitiendo en forma de radiación infrarroja (calor) o como radiación de color rojo lejano (fluorescencia de clorofila). Todo esto cambia cuando un árbol no tiene una salud óptima, baja vitalidad. Por ejemplo, después de un período de sequía, es probable que se reduzca la tasa de fotosíntesis y, como tal, más energía del sol se disipará como radiación infrarroja (calor) o como radiación roja lejana (fluorescencia de clorofila).
La fluorescencia de la clorofila es una medida no invasiva de la actividad del fotosistema II (PSII), se ha desarrollado desde una técnica bastante novedosa hasta una técnica ampliamente utilizada en fisiología vegetal. El fotosistema II es extremadamente sensible a la influencia de factores abióticos y bióticos y, como tal, la medición de esto nos permite comprender los cambios fisiológicos invisibles que una planta ha experimentado o está experimentando y nos proporciona una medida precisa de cómo el cambio ambiental puede afectar a una planta. Las herramientas y el equipo para realizar las pruebas de fluorescencia de la clorofila han mejorado enormemente durante la última década, ahora es un equipo asequible que puede caber en un bolsillo o en una pequeña bolsa que se conecta a un dispositivo de computadora portátil, como una tableta, que proporciona datos detallados y fáciles de entender sobre la salud fisiológica de los sujetos de prueba.
Aunque el uso de muchos dispositivos modernos es muy simple, la ciencia detrás de él sigue siendo compleja. A continuación se muestra un diagrama que muestra una descripción simplificada de los eventos en el fotosistema II que permiten la identificación de los parámetros clave utilizados en las pruebas de fluorescencia de clorofila. Es originalmente del análisis de fluorescencia de clorofila: una guía de buenas prácticas y comprensión de algunas aplicaciones nuevas escrita por EH Murchie y T. Lawson.
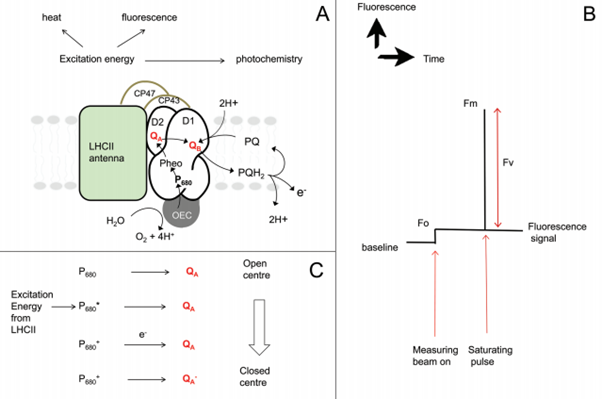
A- Una figura esquemática que muestra el transporte de electrones dentro del complejo del centro de reacción del fotosistema II. La energía que es absorbida por la clorofila dentro de este complejo de captación de luz se disipa por fotoquímica, por calor o como fluorescencia. Estos procesos siempre están en competencia lo que permite medir la eficacia del fotosistema II.
B- Muestra un rastro de fluorescencia típico realizado en un material de hoja adaptado a la oscuridad que muestra cómo se forman y. El haz de medición de la herramienta de prueba elegida excita la clorofila pero no es suficiente para poder provocar el transporte de electrones a través del fotosistema II. Esto da, la cantidad mínima de fluorescencia, los centros de reacción están abiertos en este punto. Una vez que la herramienta de medición crea un pulso de luz, se puede encontrar el rendimiento máximo posible de fluorescencia (). Durante el pulso de luz, los centros de reacción están cerrados.
C- Muestra una figura esquemática que explica cómo la transferencia de energía y electrones dentro del fotosistema II da como resultado centros abiertos y cerrados, así como la creación de y. El estado excitado y la posterior transferencia de un electrón al aceptor primario provocan un centro cerrado. no puede aceptar otro electrón hasta que haya pasado su electrón al siguiente aceptor de electrones (). Cabe señalar en el contexto de la fluorescencia de la clorofila que se unen quinonas y es un tipo de clorofila.
La medida más utilizada de la fluorescencia de la clorofila es / donde F es la diferencia entre la fluorescencia máxima () y la mínima (). Se considera que / es la medida teórica de la eficiencia cuántica del fotosistema II si todos los centros de reacción están abiertos durante la fotosíntesis. Los valores de / están generalmente entre 0,78 y 0,85 en muestras sanas y no estresadas, siendo el valor óptimo para la mayoría de las hojas 0,83.
Las pruebas de fluorescencia de clorofila tienen una amplia gama de usos dentro de la arboricultura, desde monitorear la salud del material de vivero durante el crecimiento y antes de plantar hasta inspeccionar árboles que se sospecha que se han visto afectados negativamente por cambios en el uso o desarrollo de la tierra circundante. Los dispositivos y herramientas modernos para realizar mediciones han hecho que esta forma de prueba de vitalidad esté ampliamente disponible y sea asequible, y espero ver un aumento en su uso en el futuro. El mayor inconveniente de esta prueba es que requiere hojas, lo que limita la época del año en la que la prueba se puede realizar de manera bastante significativa.
El uso de vehículos aéreos no tripulados
El desarrollo de vehículos aéreos no tripulados (UAV) durante la última década ha creado una plataforma potencial relacionada con la arboricultura para su uso. A medida que los UAV se vuelven más asequibles, accesibles y se desarrollan para poder transportar equipos más complejos, era casi inevitable que alguien intentara usarlos en el campo de la arboricultura en algún momento. Un UAV con cámara permite al usuario ver rápidamente grandes áreas de tierra, por ejemplo, un bosque, o ver las partes superiores de un árbol con mayor detalle que si esa persona estuviera parada en el suelo con binoculares. Las imágenes / video también se graban y almacenan para análisis futuros.
Ahora es posible que los vehículos aéreos no tripulados montados con equipos de imágenes térmicas y / o multiespectrales de banda estrecha se utilicen en la evaluación de la vitalidad de los árboles. La capacidad de un UAV para volar y ver un área grande en poco tiempo lo convierte en una herramienta muy versátil. Las áreas de bosque o bosque se pueden evaluar en una fracción del tiempo en comparación con a pie e inspeccionar individualmente cada árbol deseado y la vitalidad de un árbol o grupo de árboles se puede comparar fácilmente con la población de árboles más amplia. Esta es una característica importante, ya que permite a los topógrafos evaluar si se trata de árboles individuales que están estresados, grupos de árboles o incluso una población de árboles completa, pudiendo resaltar los focos de árboles estresados entre un bosque o bosque urbano es útil para evaluar cómo las especies están haciendo frente en ciertas áreas.
Las imágenes aéreas que utilizan multiespectrales térmicos y de banda estrecha detectan la fluorescencia inducida por el sol (SIF) o el calor disipado producido por los árboles durante la fotosíntesis. Cualquier alteración en la eficiencia de uno de los componentes afectará al otro. La luz que es reemitida por el árbol como fluorescencia inducida por el sol es una pequeña emisión, pero es un fuerte proxy de la fotosíntesis del árbol. Las respuestas de los árboles al estrés ambiental, como la luz, los nutrientes, la disponibilidad de agua y las temperaturas extremas, afectan la tasa fotosintética y, por lo tanto, la emisión de fluorescencia.
La temperatura del árbol está relacionada con la conductancia estomática y el enfriamiento evaporativo asociado a la transpiración. Cuando el estoma se cierra, en condiciones de estrés hídrico, la temperatura de la vegetación aumenta y la tasa de transpiración disminuye en consecuencia. En consecuencia, la temperatura del árbol se puede utilizar para obtener información sobre la transpiración y la salud del árbol.
Los árboles tienen varios mecanismos para superar la reducción excesiva de la energía luminosa transferida cuando se reduce la fotosíntesis. Esto incluye la regulación a la baja de la tasa de transporte de electrones en las células y la disipación del exceso de energía controlando el conjunto de pigmentos de xantofila. La disipación del exceso de energía por extinción no fotoquímica a través del ciclo de xantofilas es uno de estos mecanismos. La extinción no fotoquímica está relacionada con el estrés de los árboles, causado por recursos limitados y con la actividad fotosintética de los árboles a través de los cambios asociados en la reflectancia de las regiones azul y verde del espectro. Cuando se acumula un exceso de energía de excitación en la hoja, aumenta el gradiente de pH del ticaloide del cloroplasto y se activa el ciclo de las xantofilas. Estos cambios químicos afectan la absorción espectralmente selectiva de la luz,
El uso de UAV permite monitorear los cambios de árbol antes mencionados a gran escala en períodos de tiempo relativamente pequeños. Los resultados se pueden comparar fácilmente entre varias encuestas y años. La principal desventaja de esta técnica es que, al igual que las pruebas de fluorescencia de la clorofila, se basa en que los árboles estén en la hoja, lo que limita los meses de cada año en que se puede usar, sin embargo, la gran cantidad de árboles que se pueden probar a la vez reduce el obstáculo de esto, como un forestal, podría fácilmente inspeccionar todo su stock dentro de la ventana de tiempo limitada cada año. Existen restricciones para el uso de UAV en y alrededor de entornos urbanos y aeropuertos; sin embargo, con la evolución de las licencias y las competencias profesionales, esto se ha convertido en un problema menor en los últimos años.

Conclusión y discusión
Existen diversas metodologías y técnicas para medir la vitalidad de los árboles, algunas son más complejas que otras, mientras que algunas son utilizadas en su forma básica por muchas personas sin siquiera saberlo (arquitectura de copa / rama).
Los métodos como las pruebas de impedancia / admitancia eléctrica fueron prometedores y útiles en su época, sin embargo, los avances en la tecnología y la comprensión científica de los árboles, en mi opinión, han hecho de este un método obsoleto con solo usos específicos en los tiempos actuales. Sus resultados poco fiables que se vieron afectados por la época del año y los cambios posteriores en la humedad dentro de la capa cambial del árbol en cuestión hicieron que la fiabilidad de los resultados fuera impredecible.
El uso de medidas de árboles, altura y diámetro del tronco a la altura del pecho es limitado. Aunque estos son bits básicos de información que se registran regularmente durante las inspecciones / estudios de árboles, son efectivamente inútiles por sí solos. Para dar una idea de la salud del árbol, es necesario que haya mediciones de referencia para esa especie o una serie de mediciones de años anteriores del árbol inspeccionado para comparar. Cuando existe tal información, estas mediciones básicas pueden ser útiles, de manera similar cuando se compara un grupo de la misma especie de árbol, que fue plantado al mismo tiempo, tales mediciones resaltarán los especímenes que no están creciendo tan bien como el resto del grupo. Sin embargo,
El uso de la arquitectura de ramas es un gran sistema para evaluar la vitalidad de los árboles, se puede usar los 12 meses del año y requiere poca habilidad o tiempo para aprender. Creo que no es un descubrimiento o una metodología nuevos, más bien, una formalización de lo que mucha gente ya hizo, algunos sin darse cuenta. Sin embargo, es extremadamente importante tener en cuenta el punto de su ciclo de vida en el que ya se encuentra el árbol, y concluir que un árbol veterano no tiene una perspectiva de futuro positiva debido a un adelgazamiento del dosel no es solo un gran malentendido del árbol. y metodología, pero potencialmente dañino para el desarrollo de futuros hábitats de árboles antiguos y veteranos.
Prueba de fluorescencia de clorofila, este es un método muy complejo para evaluar la vitalidad de los árboles, detrás de las herramientas. Pero usar los avances modernos en herramientas de prueba es simple, rápido y preciso. El desarrollo de algunas de las herramientas más actualizadas que producen gráficos y datos fáciles de entender en una tableta es un paso significativo no solo para poder evaluar la vitalidad del árbol, sino para comunicarlo al cliente y, al mismo tiempo, justificar cualquier decisión de gestión con datos duros.
Los avances en la tecnología de UAV en los últimos años han permitido el desarrollo de su uso para la topografía de árboles. El uso sigue siendo relativamente bajo, en comparación con los otros métodos, sin embargo, tiene el potencial de cambiar las reglas del juego. El hecho de que un administrador de árboles pueda evaluar la vitalidad de todo su stock de árboles en una fracción del tiempo que normalmente tomaría es un avance significativo en el cuidado de la salud de los árboles. Permitirá al administrador de árboles señalar los árboles que muestran signos tempranos de mala salud que son invisibles a simple vista, lo que permite un tratamiento temprano.
La parte importante de cualquier evaluación de la vitalidad de un árbol es elegir el método más apropiado para la situación. Los controles y mediciones visuales son posiblemente los más utilizados y, en mi opinión, siempre se deben a su ocurrencia diaria, a veces de manera inconsciente pero todos los días para los administradores de árboles e incluso con los avances de otras técnicas, como los administradores de árboles y topógrafos de UAV. seguirá inspeccionando visualmente un árbol que haya sido resaltado por otras técnicas cuando se envíen para investigar más a fondo. Los avances de las pruebas de fluorescencia de la clorofila pueden reducir la brecha en los años futuros debido a la asequibilidad y la producción de datos de vitalidad de los árboles que se pueden utilizar en los informes; sin embargo, creo que la tecnología UAV será una parte importante del futuro de la gestión de los árboles. . La capacidad de estudiar grandes áreas de poblaciones de árboles en un corto período de tiempo, mientras se detectan cambios en la fisiología de los árboles que son invisibles a simple vista, cambia las reglas del juego. Preveo que esta tecnología se utilizará ampliamente en los próximos años y décadas como técnica de levantamiento básica e inicial, con inspecciones físicas tradicionales que se utilizarán una vez que los árboles se hayan resaltado como estresados o mostrando una vitalidad más baja de lo normal.
En última instancia, como ocurre con la mayoría de las técnicas y herramientas de inspección, una combinación de múltiples técnicas proporcionará, en mi opinión, los resultados más precisos y confiables, al tiempo que permitirá que el conjunto de herramientas de los administradores de árboles siga siendo versátil y capaz de adaptarse a la amplia gama de situaciones y entornos que el futuro traerá.
(El texto anterior se basa en la información que se encuentra originalmente en «Área foliar específica del alerce europeo ( Larix decidua MILL)».escrito por Helga Fellner, Gerald F. Dirnberger y Hubert Sterba, Pierce LL, Running SW, Walker J (1994) “Relaciones a escala regional del índice de área foliar con el área foliar específica y el contenido de nitrógeno foliar. Ecol Appl 4: 313–321 ”, Cornelissen JHCA, Lavorel SB, Garnier EB et al (2003)“ Un manual de protocolos para la medición estandarizada y sencilla de los rasgos funcionales de las plantas en todo el mundo. Austria J Bot 51: 335–380 ”, White JD, Scott NA (2006)“ Área foliar específica y distribución de nitrógeno en los bosques de Nueva Zelanda: las especies responden de forma independiente a la luz interceptada. Para Ecol Manage 226: 319–329 ”, Poorter H, Pepin S, Rijkers T et al (2006)“ Costos de construcción, composición química y tiempo de recuperación de las hojas de alta y baja irradiancia. J Exp Bot 57: 355–371 ”,“ La medición de la vitalidad de las plantas en los árboles del paisaje ”escrito por Denise Johnstone, Gregory Moore,https://www.trees.org.uk/Amenity-Conference-2020/Conference-Presentations/Conference-Presentations-2017#wed Wednesday, “Modern Arboriculture” escrito por Alex L. Shigo, Kate Maxwell, Giles N. Johnson, “Chlorophyll fluorescence — a practice guide, Journal of Experimental Botany, Volume 51, Issue 345, April 2000, Pages 659–668”, “Chlorophyll análisis de fluorescencia: una guía para las buenas prácticas y la comprensión de algunas aplicaciones nuevas ”escrito por EH Murchie y T. Lawson,“ Diagnóstico temprano de la salud de la vegetación a partir de imágenes hiperespectrales y térmicas de alta resolución: lecciones aprendidas de las relaciones empíricas y el modelado de transferencia radiativa ”escrito por R. Hernandez-Clemente, A. Hornero, M. Mottus, J. Penuelas, V. Gonzalez-Dugo, JC Jimenez, L. Suárez, L. Alonso y PJ Zarco-Tejada,“Estimación de clorofila con imágenes térmicas y multiespectrales de alta resolución de banda ancha de un sistema aéreo no tripulado que demanda máquinas vectoriales de relevancia para agricultura de precisión” escrito por Manal Elarab, Andrres M Ticlavilca, Alfonso F. Torres-Rua, Inga Maslova, Mac McKee)




